Le flavonoïde procyanidine C1 a une activité sénothérapeutique et augmente la durée de vie chez la souris
Résumé
Le déclin fonctionnel des organes associé au vieillissement et le risque accru de pathologies chroniques liées à l'âge sont dus en partie à l'accumulation de cellules sénescentes, qui développent le phénotype sécrétoire associé à la sénescence (SASP). Nous montrons ici que la procyanidine C1 (PCC1), un composant polyphénolique de l'extrait de pépins de raisin (GSE), augmente la durée de vie et la durée de vie des souris grâce à son action sur les cellules sénescentes. En criblant une bibliothèque de produits naturels, nous constatons que le GSE, et le PCC1 en tant que l'un de ses composants actifs, ont des effets spécifiques sur les cellules sénescentes. À de faibles concentrations, PCC1 semble inhiber la formation de SASP, alors qu'il tue sélectivement les cellules sénescentes à des concentrations plus élevées, éventuellement en favorisant la production d'espèces réactives de l'oxygène et le dysfonctionnement mitochondrial. Dans les modèles de rongeurs, Le PCC1 épuise les cellules sénescentes dans un microenvironnement tumoral endommagé par le traitement et améliore l'efficacité thérapeutique lorsqu'il est co-administré avec la chimiothérapie. L'administration intermittente de PCC1 à de vieilles souris irradiées, implantées de cellules sénescentes ou naturellement âgées atténue le dysfonctionnement physique et prolonge la survie. Nous identifions PCC1 comme un agent sénothérapeutique naturel avec une activité in vivo et un potentiel élevé de développement ultérieur en tant qu'intervention clinique pour retarder, soulager ou prévenir les pathologies liées à l'âge.
Le vieillissement est l'un des principaux facteurs de risque de troubles chroniques, notamment les maladies cardiovasculaires, les troubles métaboliques, les pathologies neurodégénératives et diverses malignités, qui représentent ensemble l'essentiel de la morbidité, de la mortalité et des coûts de santé dans le monde.1. Des progrès considérables ont été réalisés au cours des dernières années pour développer des agents spécifiques pour traiter des conditions individuelles liées à l'âge, telles que le diabète de type 2, l'ostéoporose, la fragilité squelettique et le dysfonctionnement vasculaire. Cependant, l'effet combiné de ces médicaments dans le contrôle de la morbidité et de la mortalité des maladies chroniques a été modeste, et ces maladies ont tendance à se produire de manière synchrone en tant que multimorbidités, la prévalence augmentant de manière exponentielle après 70 ans.2. Plusieurs facteurs majeurs affectant la durée de vie et la durée de vie ont été identifiés grâce à des études sur une gamme d'espèces et définis comme des mécanismes de vieillissement qui peuvent être classés en neuf caractéristiques3. Parmi ces mécanismes fondamentaux du vieillissement, la sénescence cellulaire a reçu une attention considérable, car elle représente un processus médicamenteux qui prévient ou retarde de multiples comorbidités du vieillissement.4. Rapportée pour la première fois dans les années 1960, la sénescence cellulaire fait référence à un état cellulaire impliquant un arrêt réplicatif essentiellement irréversible, des changements profonds de la chromatine, une résistance à l'apoptose et une synthèse protéique accrue, aboutissant fréquemment à une surproduction de cytokines pro-inflammatoires, une caractéristique appelée SASP, qui est censée conduire des phénotypes de vieillissement et diverses pathologies liées à l'âge5. Ablation de cellules sénescentes positives pour le marqueur de sénescence p16ENCRE4A atténue la dégénérescence des tissus et prolonge la durée de vie des animaux, soutenant l'affirmation selon laquelle les cellules sénescentes jouent un rôle causal dans le vieillissement de l'organisme6,7. Le succès des études précliniques a inspiré le lancement d'essais cliniques de validation de concept impliquant des sénolytiques pour plusieurs maladies humaines avec le potentiel de réduire le fardeau des cellules sénescentes in vivo grâce à une élimination pharmacologique sélective8,9,10. Depuis la première découverte en 2015 (réf. 11), une poignée d'agents sénolytiques synthétiques ou à petites molécules sont maintenant connus. Les stratégies de ciblage sont principalement basées sur le mécanisme de résistance des cellules sénescentes à l'apoptose, qui semble dépendre des voies anti-apoptotiques associées à la sénescence qui permettent la survie des cellules sénescentes pendant des périodes prolongées12,13. L'administration intermittente de sénolytiques a le potentiel de réduire le risque que les patients développent des affections indésirables, de minimiser les effets indésirables des médicaments et d'empêcher le développement de la résistance aux médicaments des cellules sénescentes, qui ne se divisent pas, une caractéristique qui les distingue des cellules cancéreuses, car les cellules cancéreuses acquièrent fréquemment des mutations avantageuses offrant une résistance contre les thérapies anticancéreuses. Cependant, la plupart des sénolytiques rapportés dépendent de la lignée cellulaire ou du type cellulaire ou, en variante, présentent une cytotoxicité substantielle in vivo, limitant ainsi leur utilisation potentielle à des fins cliniques. Dans cette étude, nous avons criblé une bibliothèque de médicaments naturels composée d'agents anti-âge et identifié plusieurs candidats dont le GSE. Une analyse plus approfondie a révélé que PCC1, un composant d'épicatéchine trimère de type B des flavonoïdes GSE, joue un rôle majeur dans l'inhibition de l'expression de la SASP à de faibles concentrations et dans la destruction des cellules sénescentes à des concentrations plus élevées, ces dernières en induisant l'apoptose. Les données précliniques suggèrent que, en combinaison avec une chimiothérapie classique, PCC1 peut réduire considérablement la taille de la tumeur et prolonger la survie dans plusieurs modèles de souris. Ainsi, PCC1 représente une nouvelle classe de sénolytiques phytochimiques isolés à partir de sources naturelles qui retardent le vieillissement et améliorent les troubles liés à l'âge et justifient une exploration plus approfondie en tant qu'agent géroprotecteur potentiel en médecine clinique. Dans le but d'identifier de nouveaux composés capables de moduler efficacement les cellules sénescentes, un criblage impartial d'agents a été effectué avec une bibliothèque phytochimique composée de 46 agents médicinaux dérivés de plantes (bibliothèque PDMA). Nous avons utilisé une lignée de cellules stromales de la prostate humaine normale primaire, PSC27, comme modèle cellulaire à cette fin. Composé principalement de fibroblastes mais avec un pourcentage mineur de lignées cellulaires non fibroblastiques, notamment des cellules endothéliales et des cellules musculaires lisses, PSC27 est une lignée cellulaire primaire en soi et développe un SASP typique après exposition à des facteurs de stress tels que la chimiothérapie génotoxique ou les rayonnements ionisants14,15,16,17. Nous avons traité ces cellules avec une dose sublétale pré-optimisée de bléomycine (50 g ml-1) et observé une augmentation de la coloration à la β-galactosidase (SA-β-Gal) associée à la sénescence, une diminution de l'incorporation de 5-bromodésoxyuridine et des foyers de réparation des dommages à l'ADN (DDR) élevés 7 à 10 jours après (Fig. 1a - c). Nous avons mis en place une stratégie de criblage pour comparer les effets des médicaments individuels sur la survie et le profil d'expression des cellules sénescentes (Extended Data Fig. 1a). Un avantage prometteur des agents sénolytiques est d'induire sélectivement la mort programmée des cellules sénescentes, telles que ABT-263, ABT-737 et l'utilisation combinée de dasatinib et de quercétine11,18,19. Nous avons d'abord testé l'efficacité de ces médicaments géroprotecteurs contre les cellules sénescentes PSC27 pour démontrer son potentiel en tant que modèle cellulaire expérimental pour le criblage de médicaments. Nos données préliminaires suggèrent que chacun de ces composés appauvrit significativement les cellules sénescentes mais pas les cellules en prolifération, confirmant ainsi la faisabilité de l'utilisation de cette lignée stromale pour d'autres études (Extended Data Fig. 1b). Lors du criblage à grande échelle de la bibliothèque de PDMA, nous avons identifié plusieurs composés ayant le potentiel de tuer sélectivement les cellules sénescentes en culture (Extended Data Fig. 1c-e). Parmi les agents présentant des effets anti-sénescence préliminaires figuraient le GSE, la quercétine, la fisétine, la curcumine et la piperlongumine (Extended Data Fig. 1d, e). La quercétine et la fisétine partagent des structures chimiques similaires, exercent des effets médicinaux similaires et sont toutes deux des sénolytiques connus11,20,21. La curcumine et la piperlongumine sont également des composés naturels avec un potentiel sénolytique récemment découvert22,23. Nous avons choisi de nous concentrer sur le GSE, qui est resté une source largement sous-explorée. Dans des conditions in vitro, GSE a supprimé le SASP avec une efficacité maximale à 0,1875 μg ml-1 (Données étendues Fig. 2a), ce qui correspond à la propriété des sénomorphes24. Des concentrations plus faibles ou plus élevées de GSE étaient moins efficaces, peut-être en raison de l'induction de réponses de stress cellulaire en raison d'une cytotoxicité accrue (Extended Data Fig. 2a). En utilisant RNA-seq, nous avons constaté que le traitement avec le GSE modifiait de manière significative le profil d'expression des cellules de sénescence, avec 2 644 gènes régulés à la baisse et 1 472 gènes régulés à la hausse à un facteur de 2,0 par gène (P < 0,01) (Données étendues Fig. 2b). Bien que l'expression de quelques gènes non liés à la SASP ait montré une tendance similaire à celle des facteurs SASP typiques (Extended Data Fig. 2c), les données de notre analyse d'enrichissement de l'ensemble de gènes (GSEA) ont soutenu l'expression réduite des signatures moléculaires du SASP ou l'activation du complexe facteur nucléaire (NF)-κB, qui est un médiateur clé du phénotype pro-inflammatoire (Extended Data Fig. 2d, e). La translocation nucléaire de p65, l'une des principales sous-unités du complexe NF-κB, a été observée dans les cellules sénescentes, ce qui est cohérent avec son engagement fonctionnel dans l'expression de SASP14 (Données étendues Fig. 2f). Il est à noter que cette tendance était considérablement contrariée par le GSE à de faibles concentrations (telles que 0,1875 μg ml-1). Inversement, l'activation de la signalisation NF-κB n'était pas supprimée mais semblait plutôt améliorée lorsque le GSE était utilisé à des concentrations plus élevées (telles que 3,7500 μg ml-1), suggérant des réponses différentielles des cellules sénescentes dans ces conditions de traitement. L'activation de la signalisation DDR, comme en témoigne la phosphorylation de la kinase ATM dans les fractions nucléaires, et l'expression du ligand de chimiokine du motif C-X-C (CXCL)8, l'un des facteurs de marque SASP, comme observé dans les fractions cytoplasmiques, étaient compatibles avec la NF -κB activation dans ces paramètres (Extended Data Fig. 2f). Le profil d'interaction protéine-protéine a révélé un réseau très actif impliquant de multiples facteurs significativement régulés à la hausse lors de la sénescence cellulaire mais régulés à la baisse une fois que les cellules ont été exposées au GSE (Extended Data Fig. 3a). Le profilage de l'ontologie génique a révélé que ces molécules sont fonctionnellement engagées dans des processus biologiques et associées à des composants cellulaires généralement compatibles avec la nature sécrétée de la SASP (Extended Data Fig. 3b,c). Ainsi, le GSE est un produit naturel qui détient le potentiel de contrôler le profil pro-inflammatoire des cellules sénescentes, le SASP, lorsqu'il est utilisé dans une plage de concentration spécifique. Bien que le GSE ne soit pas le seul produit naturel ayant une efficacité sénolytique dans nos tests cellulaires (Extended Data Fig. 1d, e), notre étude ultérieure s'est largement concentrée sur le GSE, car sa capacité géroprotectrice est apparue particulièrement frappante. Compte tenu de l'efficacité du GSE dans la réduction de la SASP en tant qu'agent sénomorphe, nous avons ensuite interrogé le potentiel de ce produit naturel pour tuer les cellules sénescentes à des concentrations plus élevées en agissant comme sénolytique. La coloration SA-β-Gal a indiqué que les cellules sénescentes ont été éliminées à une concentration de GSE de 0,75 g ml-1 (Figure. 1a,b). À 3,75 μg ml-1 GSE, un plateau de 20% de survie des cellules sénescentes a été atteint (Fig. 1a,b). une, Quantification de la survie des cellules PSC27 sénescentes par la positivité SA-β-Gal. Le GSE a été appliqué au milieu à des concentrations croissantes. CTRL, cellules de contrôle (en prolifération) ; SEN, cellules sénescentes ; NS, non significatif. P les valeurs ont été calculées par ANOVA à un facteur avec le test de comparaison multiple de Tukey. b, Images représentatives affichant la coloration SA-β-Gal après traitement des cellules PSC27 avec différentes concentrations de GSE. Barre d'échelle, 20 m. Les données sont représentatives de trois expériences indépendantes. DMSO, diméthylsulfoxyde. c, Analyse de survie des cellules PSC27 témoins et sénescentes après traitement avec du GSE (à des concentrations de 0,3750, 0,7500, 1,8750, 3,7500, 7,5000 et 15,0000 g ml-1, respectivement). Les données sont présentées sous forme de moyenne ± écart-type et ont été dérivées de trois réplicats biologiques (m = 3 tests indépendants). P les valeurs ont été calculées par bilatéral t-tests. ré, Mesure de l'évolution dans le temps de la viabilité in vitro lors du traitement des cellules PSC27 témoins et sénescentes avec du GSE (3,75 g ml-1). Les données sont présentées sous forme de moyenne ± écart-type et ont été dérivées de trois réplicats biologiques (m = 3 expériences indépendantes). P les valeurs ont été calculées par bilatéral t-tests. Et, Mesure par cytométrie en flux de cellules PSC27 témoins et sénescentes après traitement avec un kit annexine V-FITC et iodure de propidium (PI) et coloration au 4,6-diamidino-2-phénylindole (DAPI) pour déterminer l'étendue de l'apoptose. T1 à T4, quartiles 1 à 4. F, Quantification comparative du pourcentage de viables (Q4, PI−annexine V−) et apoptotique (Q2 et Q3, PI+annexine V+ et PI−annexine V+, respectivement) cellules dans les populations témoins ou sénescentes traitées avec le véhicule ou le GSE pendant 3 jours (m = 3 tests biologiquement indépendants). P les valeurs ont été calculées par bilatéral t-tests. g, Mesure du signal de fluorescence de MitoSOX Red, un indicateur de superoxyde mitochondrial, dans des cellules PSC27 dans différentes conditions. P les valeurs ont été calculées par bilatéral t-tests. h, Spectres de masse haute résolution montrant le chromatogramme d'ions totaux (TIC) et le chromatogramme de pic de base de GSE après avoir effectué HPLC-ESI-QTOF-MS. Sauf indication contraire, les cellules ont été soumises à des analyses pertinentes 3 jours après le traitement GSE dans les conditions de culture. cps, compte par seconde. Les données dans les graphiques à barres et les courbes de régression sont présentées sous forme de moyenne ± écart-type et sont représentatives de trois répétitions biologiques. NS, P > 0,05 ; *P <0,05 ; **P <0,01 ; ***P <0,001 ; ****P <0,0001. Les tests de viabilité cellulaire ont montré que le GSE induisait la mort cellulaire sénescente mais pas la mort cellulaire proliférante à partir d'une concentration de 0,75 g ml-1 (Figure. 1c). A une concentration de 7,50 g ml-1, le pourcentage de cellules sénescentes survivantes a diminué à environ 10 %, tandis que la viabilité des cellules en prolifération n'a pas été affectée même à 15,00 μg ml-1 GSE (Fig. 1c), la concentration la plus élevée utilisée dans nos analyses cellulaires, suggérant une sélectivité et une spécificité importantes de la GSE contre les cellules sénescentes, qui sont des traits majeurs des sénolytiques. Nous avons ensuite mesuré la capacité du GSE à cibler de manière différentielle les cellules sénescentes au cours du temps. Après traitement avec du GSE à une concentration de 3,75 g ml-1, la viabilité des cellules sénescentes ne diminue significativement qu'après 20 h. La différence de viabilité entre les cellules sénescentes et le contrôle (cellules en prolifération) a atteint un maximum après 32 h, impliquant une hétérogénéité de la résistance intrinsèque aux sénolytiques dans les populations de cellules sénescentes (Fig. 1j). Comme le GSE génère des effets distincts contre les cellules sénescentes, nous avons analysé l'efficacité du GSE pour induire l'apoptose cellulaire. La cytométrie en flux a démontré une viabilité significativement réduite, tandis que l'apoptose des cellules sénescentes mais pas celle des cellules en prolifération était élevée (Fig. 1e,f et Fig. 2a). Le dysfonctionnement mitochondrial et les changements métaboliques sont parmi les caractéristiques des cellules sénescentes et du vieillissement de l'organisme, des événements provoquant un stress oxydatif et la production d'espèces réactives de l'oxygène (ROS) telles que le superoxyde3,25. Nous avons utilisé MitoSOX Red, un indicateur de superoxyde mitochondrial26, pour sonder les changements intercellulaires et a découvert que le GSE favorisait la génération de ROS mitochondriales dans les cellules sénescentes mais pas dans les cellules en prolifération (Fig. 1g). Ainsi, nos données sont cohérentes avec un modèle dans lequel le GSE tue les cellules sénescentes par induction de l'apoptose et exacerbation du stress mitochondrial in vitro. Les pépins de raisin représentent 38 à 52 %, sur une base de matière sèche, des raisins et constituent une abondante source d'antioxydants27. Nous avons appliqué la chromatographie liquide haute pression (HPLC) couplée à la spectrométrie de masse à temps de vol quadripolaire (QTOF-MS) équipée d'une interface d'ionisation électrospray (ESI) pour identifier les principaux composants de la GSE. Nous avons trouvé trois grandes catégories de composés phytochimiques, notamment les acides phénoliques, les flavonoïdes (tels que le flavan-3-ol, les procyanidines) et d'autres composés (Fig. 1h et tableau supplémentaire 1). Parmi eux, quelques composants ont été identifiés comme des procyanidines et leurs dérivés, qui ciblent les protéines mitochondriales et soulagent de multiples maladies chroniques.28. Cependant, le ou les principaux composants intervenant dans la fonction sénolytique de la GSE restent en grande partie incertains. Les activités biologiques signalées des procyanidines de pépins de raisin comprennent la réduction des dommages oxydatifs, la suppression de l'inflammation et l'induction de l'apoptose des cellules cancéreuses29,30,31,32. Parmi les composés individuels trouvés dans le GSE, le PCC1 mérite une attention particulière, car il a été démontré qu'il induisait des dommages à l'ADN, provoquait l'arrêt du cycle cellulaire et augmentait l'expression des kinases de point de contrôle.33. Les données de l'analyse préliminaire (chromatogramme d'ions totaux) de GSE, un mélange d'agents phytochimiques en soi, par HPLC-QTOF-MS ont suggéré la présence de PCC1, car le profil de GSE à des pics MS spécifiques correspondait au profil de chromatogramme de PCC1 chimiquement pur. acquis auprès d'une source commerciale (Fig. 1h et Fig. 2b). Il a été démontré que PCC1 diminue le niveau de BCL-2 mais augmente l'expression du régulateur BAX et les activités des caspases 3 et 9 dans les cellules cancéreuses en culture, générant ainsi potentiellement des effets anticancéreux par induction de l'apoptose33. Par conséquent, nous avons ensuite évalué la capacité et la sélectivité de PCC1 pour éliminer les cellules sénescentes en culture. Les données suggèrent que PCC1 est sénolytique pour les cellules stromales sénescentes à partir d'une concentration de 50 M, à laquelle les cellules en prolifération restent largement inchangées (Fig. 2a,b et tableau supplémentaire 2). Bien que des concentrations plus élevées aient entraîné un taux de survie plus faible des cellules sénescentes, avec un seuil d'environ 200 M, PCC1 n'a présenté de toxicité envers les cellules témoins qu'à 600 M ou plus (Fig. 2b). Une évolution temporelle de l'activité de la caspase 3/7 a indiqué que PCC1 exerçait des effets apoptotiques dans les 12 h, atteignant un plateau à 24 h (Fig. 2c). Ce résultat était largement cohérent avec les mesures de viabilité (Fig. 2d). La nature sénolytique de PCC1 a été confirmée par des cellules qui sont entrées en sénescence en raison d'un épuisement ou d'une sénescence réplicative (RS) ou d'un oncogène (HRASG12V) surexpression (OIS), qui génère des insultes stressantes similaires à celles de la sénescence induite par la thérapie (Fig. 2e, Données étendues Fig. 4b - e et tableau supplémentaire 2). Ensemble, les résultats suggèrent que PCC1 efface sélectivement les cellules stromales humaines sénescentes induites par différents stimuli de manière dose-dépendante mais sans effet significatif sur les cellules non sénescentes lorsqu'il est utilisé à des concentrations appropriées. une, Mesure de la survie des cellules PSC27 sénescentes par coloration SA-β-Gal. Le PCC1 a été appliqué à des concentrations croissantes. P les valeurs ont été calculées par ANOVA à un facteur avec le test de comparaison multiple de Tukey. b, Survie des cellules PSC27 sénescentes induites par la bléomycine à des concentrations croissantes de PCC1. c, Dosage apoptotique de l'activité de la caspase 3/7. ré, Courbes de survie dans le temps pour évaluer la viabilité des cellules PSC27 après traitement PCC1. Et, Images de coloration SA-β-Gal. TIS, sénescence induite par la thérapie (par la bléomycine). Barre d'échelle, 20 m. Les données sont représentatives de trois expériences indépendantes. F, Cytométrie en flux après traitement avec un kit annexine V-FITC et PI et coloration DAPI pour déterminer les niveaux d'apoptose. g, Quantification du pourcentage de viables (Q4, PI−annexine V−) et apoptotique (Q2 et Q3, PI+annexine V+ et PI−annexine V+, respectivement) cellules après traitement avec véhicule ou PCC1 pendant 3 jours (m = 3 tests biologiquement indépendants). h, Coloration par immunofluorescence des cellules PSC27. RS a été induite par des passages en série avant le traitement PCC1. Rouge, p16INK4a. Des cellules à un passage précoce (P10) ont été utilisées comme contrôle négatif. L'ABT-263 (1,25 µM) a été testé comme contrôle positif. Barre d'échelle, 20 m. je, Statistiques de coloration par immunofluorescence. j, activité sénolytique induite par PCC1 après inhibition de la pan-caspase (20 M QVD-OPh). à, dosage de PD de MSC humaines. PCC1 a été appliqué le 8ème jour après le début des expériences comme indiqué. BLEO, bléomycine. Pour c,ré,à, les données sont présentées sous forme de moyenne ± écart-type et ont été dérivées de trois réplicats biologiques (m = 3 tests indépendants). Pour les données en b-ré,g,je,j, P les valeurs ont été calculées par bilatéral t-tests. Dans des expériences pour c-à, PCC1 a été utilisé à 100 M. Sauf indication contraire, les échantillons ont été prélevés pour les analyses 3 jours après le traitement PCC1. Les données dans les graphiques à barres sont présentées sous forme de moyenne ± écart-type et sont représentatives de trois répétitions biologiques. NS, P > 0,05 ; *P <0,05 ; **P <0,01 ; ***P <0,001 ; ****P <0,0001. Pour étendre expérimentalement et établir l'efficacité de PCC1 dans toutes les lignées cellulaires, nous avons traité des fibroblastes pulmonaires fœtaux humains (WI38), des cellules endothéliales primaires de veine ombilicale humaine (HUVEC) et des cellules souches mésenchymateuses humaines (CSM) avec PCC1 et avons constaté que les cellules sénescentes de toutes ces lignées présentaient sensibilité similaire à l'ablation sélective par PCC1, alors que leurs homologues non sénescents sont restés viables (Extended Data Fig. 4f–h et tableau supplémentaire 3). Nous avons en outre confirmé l'induction de l'apoptose dans les cellules sénescentes en réponse à PCC1 par cytométrie en flux, alors que les cellules en prolifération sont restées en grande partie non affectées par PCC1 (Fig. 2f,g). En résumé, nos données montrent que PCC1 élimine sélectivement les cellules sénescentes dans divers types de cellules et résultant de différents déclencheurs de sénescence. Pour visualiser l'épuisement des cellules sénescentes par PCC1, nous avons examiné l'expression de p16INK4a, un marqueur de sénescence largement utilisé, dans les cellules stromales ayant subi une RS. PCC1 a efficacement éliminé les cellules sénescentes p16-positives, qui n'apparaissaient que dans les populations de PSC27 à passage tardif, avec une efficacité ressemblant largement à celle de l'ABT-263 (1,25 M), un agent sénolytique synthétique bien établi18,21 (Figure. 2h, je). Pour prouver que l'élimination des cellules sénescentes médiée par PCC1 se produit principalement par induction de l'apoptose, plutôt que par d'autres formes de mort cellulaire programmée, nous avons traité les cellules avec l'inhibiteur de l'apoptose pan-caspase quinolyl-valyl-LA-méthylaspartyl-(-2,6-difluorophénoxy)-méthylcétone (QVD-OPh). La capacité de PCC1 à tuer les cellules sénescentes a été inversée par QVD-OPh. PCC1 partage donc son induction de l'apoptose dépendante de la caspase en tant que caractéristique sénolytique avec ABT-263 (Fig. 2j). Une analyse plus poussée avec des inhibiteurs chimiques a exclu la mort cellulaire induite par PCC1 par ferroptose, pyroptose ou nécroptose (Extended Data Fig. 4i). Pour évaluer le potentiel de doublement de la population cellulaire (PD) après un traitement avec des médicaments génotoxiques, nous avons utilisé des CSM, qui peuvent s'auto-renouveler et reprendre la prolifération basée sur les colonies même après une exposition à des stress environnementaux.34, probablement en raison de l'hétérogénéité des dommages, les cellules subissant moins de dommages, vraisemblablement capables de conserver le potentiel de s'auto-récupérer et de réintégrer le cycle cellulaire24,35. Contrairement aux cellules endommagées par la bléomycine, qui sont rapidement entrées en arrêt de croissance après le traitement, le traitement post-sénescence avec PCC1 a considérablement amélioré la capacité de DP des MSC, en particulier après l'élimination des cellules sénescentes développant le SASP et ayant le potentiel d'induire une sénescence paracrine au sein des populations cellulaires (Fig. . 2k). Cependant, le traitement avec PCC1 n'a pas affecté la PD des cellules en prolifération, ce qui indique davantage la sélectivité de PCC1 pour les cellules sénescentes par rapport à leurs homologues normales. Comme le GSE est un mélange phytochimique complexe, plusieurs de ses composants ont des activités antioxydantes et anti-inflammatoires.27,36, nous avons cherché à savoir si PCC1 était le principal constituant du GSE impliqué dans l'épuisement des cellules sénescentes ou si des composés phytochimiques alternatifs dans le GSE pouvaient contribuer à son effet sénolytique global. À cette fin, nous avons examiné l'influence de molécules phytochimiques individuelles sur la survie des cellules PSC27 sénescentes. La plupart des composants du GSE n'ont pas présenté d'activité sénolytique dans la plage de doses de PCC1 et n'ont pas causé la mort significative des cellules en prolifération (Figs. 3 et 4). Bien que la quercétine flavonoïde ait montré une activité sénolytique comme dans nos études précédentes, une propriété partagée avec les flavones naturelles11,21, « GSE reconstitué », constitué des principaux composants mélangés en fonction de leur pourcentage en masse tel que révélé par nos données HPLC-QTOF-MS (tableau supplémentaire 1, notez que la quercétine ne représente que 0,9 %) mais en excluant volontairement PCC1, n'a pas montré de résultats similaires à ceux observés pour PCC1 dans les deux tests (Figs supplémentaires. 3 et 4). Bien que nous ne puissions pas conclure si d'autres composants ont une contribution, nos données suggèrent clairement que PCC1 est un médiateur principal de l'effet sénolytique du GSE. Compte tenu de l'efficacité importante de PCC1 dans l'induction sélective de la mort cellulaire sénescente, nous avons interrogé le(s) mécanisme(s) sous-jacent(s). PCC1 appartient à la superfamille des flavonoïdes, qui peuvent piéger les radicaux libres, chélater les métaux et réduire la formation d'hydroperoxyde, propriétés antioxydantes attribuables au groupe fonctionnel « -OH » dans la structure et à sa position sur le cycle de la molécule de flavonoïde27. La capacité antioxydante des procyanidines est, en partie, régie par leur degré de polymérisation, tandis que PCC1 est un trimère d'épicatéchine de procyanidine par nature (Fig. 3a). une, Structure chimique de l'épicatéchine trimérique PCC1. b, Heatmap illustrant les gènes supérieurs (50) significativement régulés positivement dans les cellules PSC27 sénescentes mais diminués lors du traitement PCC1 (50 M). Étoiles rouges, facteurs SASP. c, tracé GSEA d'un ensemble de gènes significatif dans le spectre SASP. FDR, taux de fausses découvertes ; NES, score d'enrichissement normalisé. ré, tracé GSEA d'un ensemble de gènes significatif associé à la signalisation médiée par NF-κB. Et, Carte NetworkAnalyst des interactions protéine-protéine des facteurs typiques associés à la SASP régulée positivement de manière significative dans les cellules sénescentes mais diminuée par le traitement PCC1. F, Heatmap montrant l'expression différentielle des gènes de la famille BCL-2 dans les cellules sénescentes témoins, sénescentes et traitées par PCC1. g, Immunoblot de cellules PSC27 exposées à différents agents. L'expression des facteurs pro-apoptotiques et anti-apoptotiques et des molécules associées à la signalisation DDR a été examinée. Caspase 3 (t), caspase totale 3; caspase 3 (c), caspase 3 clivée; p, phosphorylé. β-actine et GAPDH, contrôles de charge. Les données sont représentatives de trois expériences indépendantes. h, Les cellules ont été infectées avec trois espèces d'ARN en épingle à cheveux courtes différentes ciblant BLESSURE ou PUMA avant d'être exposé à la bléomycine pour induire la sénescence. Sept jours plus tard, les cellules ont été traitées avec PCC1 (100 M) pendant une période de 3 jours pour induire l'apoptose. SCR, brouiller. je, BLESSURE l'expression a été déterminée par PCR quantitative avec transcription inverse (RT-qPCR). Les cellules ont été traitées avec de la bléomycine pour induire la sénescence avant exposition à 100 M de PCC1 pendant 3 jours en l'absence ou en présence de 10 M de MK2206, 10 M de ruxolitinib ou 20 nM de BMS-582949 pour inhiber l'activité de AKT, JAK1 et/ou JAK2 ou p38 MAPK, respectivement. j, Un ensemble similaire de tests d'expression RT-qPCR pour PUMA en utilisant les conditions décrites dans je. à-m, Mesure de la viabilité cellulaire après traitement PCC1 en l'absence ou en présence de MK2206 (à), le ruxolitinib (l) ou BMS-582949 (m), inclus pour inhiber l'activité enzymatique de AKT, JAK1 et/ou JAK2 ou p38 MAPK, respectivement. Pour les données en c,ré, P les valeurs ont été calculées par ANOVA à un facteur avec la comparaison post hoc de Tukey. Importance statistique dans h-m a été calculé en utilisant les deux côtés t-tests ou ANOVA à sens unique (test de Dunnett). Les données dans tous les graphiques à barres sont présentées sous forme de moyenne ± écart-type et représentent trois répétitions biologiques. NS, P > 0,05 ; *P <0,05 ; **P <0,01 ; ***P <0,001 ; ****P <0,0001. Nous avons d'abord analysé l'impact de PCC1 sur l'expression à l'échelle du transcriptome des cellules sénescentes. La bioinformatique a montré que 4 406 gènes étaient significativement régulés à la hausse et 2 766 gènes étaient régulés à la baisse dans les cellules stromales après le traitement PCC1 (Fig. 5a). Nous avons observé un large éventail de facteurs SASP, dont l'expression était nettement régulée à la hausse pendant la sénescence cellulaire mais sensiblement régulée à la baisse lorsque les cellules sénescentes étaient exposées à PCC1 (Fig. 3b). Le profilage GSEA a montré que les signatures SASP et NF-κB étaient remarquablement supprimées par le traitement PCC1 (Fig. 3c,d). Nous avons en outre remarqué de multiples interactions mutuelles ou connexions fonctionnelles entre ces facteurs régulés positivement pendant la sénescence et diminués après le traitement par PCC1 apparaissant dans la liste des principaux gènes différentiellement exprimés, dont la plupart étaient généralement des facteurs sécrétés (Fig. 3e). Pour comprendre la sélectivité de PCC1 pour les cellules sénescentes, nous avons en outre évalué le profil d'expression transcriptomique et remarqué que PCC1 induisait des changements d'expression chez quelques membres de la superfamille BCL-2 (Fig. 3f). Bien que la signalisation DDR soit restée largement inchangée, une régulation à la hausse ou une activation dépendante de PCC1 de la protéine kinase activée par le mitogène p38 (MAPK) a été observée, avec un clivage de la caspase 3 se produisant dans ces cellules (Fig. 3g). Bien que l'expression de BCL-xL ait été élevée dans les cellules sénescentes par rapport à celle de leurs témoins en prolifération, le traitement par PCC1 n'a pas amélioré davantage son niveau de protéine. Les niveaux des deux autres facteurs BCL-2, à savoir BCL-2 et BAX, sont restés en grande partie inchangés. Alors que NOXA et PUMA (deux membres de la sous-famille pro-apoptotique du domaine d'homologie BCL-2 (BH3) uniquement) présentaient des modèles d'expression différents au cours de la sénescence cellulaire, le traitement par PCC1 a entraîné une régulation à la hausse des deux facteurs (Fig. 3g). La suppression des facteurs pro-apoptotiques de BCL-2 a suggéré que NOXA et PUMA médiaient partiellement les actions sénolytiques de PCC1 (Fig. 3h et données étendues Fig. 5a–c). Le traitement avec des inhibiteurs chimiques de la signalisation AKT kinase, Janus kinase (JAK)1, JAK2 et p38 MAPK a également suggéré l'implication de ces voies de signalisation dans l'expression de PMAIP1 (BLESSURE) et BBC3 (PUMA) et l'apoptose des cellules sénescentes après traitement par PCC1 (Fig. 3h–m). Comme renverser BLESSURE et PUMA n'a inhibé que partiellement l'effet sénolytique du PCC1 (Fig. 3h, k – m), nous avons étudié d'autres mécanismes possibles conduisant à la mort cellulaire sénescente. Parce que les procyanidines augmentent généralement la viabilité cellulaire, diminuent la production de ROS et limitent le stress oxydatif dans les cellules de mammifères37,38, nous avons ensuite demandé si des effets similaires ou antioxydants pouvaient être observés dans les cellules sénescentes exposées au PCC1. Étonnamment, nous avons constaté que le contraire était le cas, car les cellules sénescentes PSC27 présentaient des niveaux élevés de ROS lorsqu'elles étaient traitées avec PCC1, contrairement à leurs homologues en prolifération (Fig. 4a et données étendues Fig. 5j, noter les signaux de la sonde 2′-7′-dichlorodihydrofluorescéine diacétate (DCFH-DA)). Traitement avec le HS-1793, un analogue stable du resvératrol qui a une activité antiradicalaire39, a effectivement bloqué la production de ROS dans les cellules sénescentes traitées avec PCC1 (Extended Data Fig. 5e,f), alors que les niveaux de ROS ont encore augmenté après l'exposition de cellules sénescentes traitées par PCC1 à CCCP, un découpleur mitochondrial de protonophore40, ou ruxotemitide (LTX-315), un peptide cationique amphipathique qui induit la perméabilisation de la membrane mitochondriale externe41, chacun appliqué à des concentrations qui n'étaient pas cytotoxiques pour les cellules témoins (Extended Data Fig. 5e,f). Bien que le traitement par CCCP ou ruxotemitide en soi ait également entraîné une production accrue de ROS, les effets étaient généralement plus faibles que ceux induits par PCC1, suggérant que PCC1 déclenche un dysfonctionnement mitochondrial dans les cellules sénescentes. En mesurant l'indice d'apoptose des cellules sénescentes (activité caspase 3/7), nous avons constaté que l'effet induit par PCC1 pouvait être encore amélioré lors de la combinaison de PCC1 avec chaque perturbateur mitochondrial mais supprimé lors d'un co-traitement avec HS-1793 (Extended Data Fig . 5g). une, Mesure des niveaux de ROS avec DCFH-DA, une sonde fluorescente perméable aux cellules sensible aux changements de l'état redox cellulaire. Les expériences ont été réalisées 1 jour après le traitement PCC1. A gauche, images représentatives. Barre d'échelle, 10 m. Bon, les statistiques. DCF, dichlorodihydrofluorescéine. b, Immunoblot après exposition des cellules à différents traitements. La distribution du cytochrome c entre les mitochondries et le cytoplasme a été profilée en isolant les mitochondries des surnageants du cytosol 3 jours après le traitement PCC1. La COX IV est l'enzyme terminale de la chaîne respiratoire mitochondriale et un marqueur mitochondrial. c, Courbes de survie dans le temps pour évaluer la viabilité des cellules PSC27 après traitement avec PCB2, un autre membre de la famille des procyanidines naturelles. Les données sont présentées sous forme de moyenne ± écart-type et ont été dérivées de trois réplicats biologiques (m = 3 tests indépendants). ré, test de production de ROS effectué d'une manière similaire à celle décrite dans une, sauf que les cellules ont été exposées au PCB2. Barre d'échelle, 10 m. Et, Immunoblot de l'expression et de la distribution de l'ATM, de la p53 et de la caspase 3 entre le cytoplasme et le noyau. GAPDH et lamin A/C, contrôles de chargement pour le cytoplasme et les noyaux, respectivement. C1, PCC1 ; B2, PCB2. F, Microscopie confocale de coloration par immunofluorescence après traitement des cellules avec véhicule (DMSO) ou PCC1. Des anticorps primaires spécifiques de p53 ou de COX IV ont été appliqués. Barre d'échelle, 10 m. g, Analyse par immunotransfert de cellules PSC27 exposées à différents agents. Cyto, cytoplasmique; mito, mitochondrial. h, Analyse de la coloration JC-1, une sonde fluorescente indicative de m. Les signaux ont été mesurés sur 3 jours. La fluorescence verte indique les monomères JC-1 (ils apparaissent dans le cytosol après la dépolarisation de la membrane mitochondriale et indiquent une apoptose précoce). La fluorescence rouge indique l'agrégation JC-1 (se trouve sur les mitochondries intactes). A gauche, images représentatives. Bon, les statistiques. PCC1 et PCB2 ont tous deux été utilisés à 100 M dans des dosages pertinents. Données dans b,Et-g sont représentatifs de trois expériences indépendantes. Importance statistique dans une (à droite), ré (à droite) et h (à droite) a été calculé en utilisant t-tests, et qu'en c a été calculé avec ANOVA à un facteur (test de Dunnett). Les données dans tous les graphiques à barres sont présentées sous forme de moyenne ± écart-type et sont représentatives de trois répétitions biologiques. NS, P > 0,05 ; *P <0,05 ; **P <0,01. La libération du cytochrome c et la rupture de la membrane mitochondriale sont des événements intracellulaires associés à l'apoptose et agissent souvent comme des moteurs directs de l'apoptose42. Nos données suggèrent que le traitement par PCC1 a amélioré la libération du cytochrome c des mitochondries vers l'espace cytoplasmique environnant (Fig. 4b et données étendues Fig. 5h). La libération de cytochrome c par les mitochondries est largement compatible avec des réactions biochimiques telles que l'activation de caspases dans les cellules sénescentes traitées par PCC1 (Fig. 3g). Les membres de la famille des procyanidines présentent un large spectre de propriétés pharmacologiques, notamment anti-oxydantes et anti-inflammatoires, qui sont à l'opposé de ce que nous avons observé lors du traitement des cellules sénescentes avec PCC1. Les données actuelles nous ont amenés à nous demander si les effets du PCC1 sont reproduits par d'autres procyanidines. La procyanidine B2 (PCB2) est un flavonoïde représentatif qui existe sous forme de dimère et réduit les niveaux de ROS pendant le stress oxydatif dans les cellules en culture43. PCB2 n'a pas réussi à éliminer les cellules sénescentes (Fig. 4c et Figs supplémentaires. 3b et 4b) et ni la production accrue de ROS ni la libération mitochondriale induite du cytochrome c dans les cellules sénescentes (Fig. 4d et données étendues Fig. 5i). Une quantité substantielle de p65 (RelA), l'une des sous-unités majeures du complexe NF-κB, a été transférée dans le noyau des cellules sénescentes (Fig. 4e). Bien que le traitement au PCB2 ait contrecarré la translocation nucléaire de p65, ce qui est cohérent avec sa capacité anti-inflammatoire, cet effet n'a pas été reproduit par PCC1 (Fig. 4e). Les cellules sénescentes exposées au PCC1 présentaient un clivage remarquable de la caspase 3, contrairement à celles traitées avec le PCB2, différenciant davantage l'activité biologique de ces deux molécules de procyanidine (Fig. 4e). En tant que facteur qui régit fonctionnellement le destin cellulaire, p53 peut induire l'apoptose soit en transactivant des gènes pro-apoptotiques, soit de manière indépendante de la transcription en se transférant dans les mitochondries.44. Nous avons observé une augmentation de la translocation nucléaire de p53 lors de la sénescence cellulaire, un modèle nettement réduit par PCC1, mais beaucoup moins que par PCB2 (Fig. 4e, f). Comme l'exclusion nucléaire de p53 est une étape critique dans l'induction de l'apoptose des cellules sénescentes45, nous avons en outre évalué la distribution de p53. La coloration par immunofluorescence a indiqué un chevauchement considérablement accru de p53 avec la sous-unité IV de la cytochrome c oxydase (COX IV) (un complexe protéique transmembranaire dans la chaîne électronique respiratoire mitochondriale, souvent utilisé comme marqueur de protéine résidente mitochondriale) dans les cellules sénescentes traitées par PCC1, suggérant une translocation améliorée de p53 dans la matrice mitochondriale. Bien que nous ayons observé du p53 dans les mitochondries des cellules en prolifération, PCC1 n'a pas induit un afflux remarquable ou complet de protéine p53 dans la matrice mitochondriale des cellules en prolifération (Fig. 4f). Cependant, dans les cellules sénescentes, les niveaux de p53 ont diminué dans les noyaux mais ont augmenté dans les mitochondries lors de l'exposition à PCC1 (Fig. 4g). Le déclin du potentiel membranaire mitochondrial (Δψm) est un événement qui peut déclencher l'apoptose par la voie intrinsèque à médiation mitochondriale46. Nous avons constaté que m était significativement réduit dans les cellules sénescentes, tandis que les cellules en prolifération restaient pratiquement inchangées en présence de PCC1, comme indiqué par le profil des signaux de la sonde JC-1 (Fig. 4h). Ainsi, PCC1 favorise la génération de ROS, déclenche la libération du cytochrome c et provoque une perturbation Δψm dans les cellules sénescentes, des événements intrinsèquement associés à l'incapacité mitochondriale et à l'apoptose cellulaire entraînant fonctionnellement. Ensemble, nos données expérimentales suggèrent que les cellules sénescentes sont soumises à l'apoptose induite par PCC1, un processus partiellement médié par BLESSURE et PUMA régulation positive et associée à une production accrue de ROS et à un dysfonctionnement mitochondrial. Compte tenu de la capacité et de la sélectivité de PCC1 à éliminer les cellules sénescentes in vitro, nous nous sommes ensuite demandé si cet agent pouvait être exploité pour intervenir contre les pathologies liées à l'âge in vivo. En oncologie clinique, la résistance aux médicaments limite l'efficacité de la plupart des traitements anticancéreux, tandis que les cellules sénescentes contribuent fréquemment à la résistance thérapeutique par le développement d'un SASP in vivo dans le microenvironnement tumoral endommagé par les médicaments (TME)15,16,47. L'élimination pharmacologique des cellules sénescentes induites par la thérapie minimise les effets secondaires de la chimiothérapie et prévient la récurrence du cancer chez les animaux48. Cependant, la faisabilité de la déplétion médiée par PCC1 des cellules sénescentes des tumeurs primaires pour améliorer l'efficacité des traitements anticancéreux reste largement inconnue. Tout d'abord, nous avons choisi de construire des recombinants tissulaires en mélangeant des cellules PSC27 avec des cellules PC3, qui sont une lignée cellulaire typique du cancer de la prostate de malignité élevée, à un rapport pré-optimisé (1:4)14. Les cellules ont ensuite été implantées par voie sous-cutanée dans le flanc postérieur de souris atteintes de diabète non obèse et d'immunodéficience combinée sévère (NOD-SCID). Les tumeurs des animaux ont été mesurées à la fin d'une période de 8 semaines, et les tissus ont été acquis pour une évaluation pathologique. Par rapport aux tumeurs comprenant des cellules cancéreuses PC3 et des cellules stromales PSC27 naïves, les xénogreffes composées de cellules PC3 et de cellules PSC27 sénescentes présentaient un volume significativement accru, confirmant les effets favorisant la croissance tumorale des cellules sénescentes (Extended Data Fig. 6a). Pour imiter les conditions cliniques, nous avons conçu expérimentalement un schéma préclinique incorporant des thérapies génotoxiques et/ou sénolytiques (Fig. 5a). Deux semaines après l'implantation sous-cutanée, lorsqu'une fixation stable des tumeurs in vivo a été observée, une dose unique de mitoxantrone (MIT, un médicament chimiothérapeutique) ou de placebo a été administrée aux animaux le 1er jour des 3e, 5e et 7e semaines jusqu'à la fin de le régime de 8 semaines (données étendues fig. 6b). Contrairement au groupe traité par placebo, l'administration de MIT a remarquablement retardé la croissance tumorale, validant l'efficacité du MIT en tant qu'agent chimiothérapeutique (réduction de 44,0% de la taille de la tumeur) (Fig. 5b). Notamment, bien que l'administration de PCC1 lui-même n'ait pas provoqué de rétrécissement de la tumeur, le traitement avec le MIT suivi de l'administration de PCC1 (à 20 mg par kg par injection intrapéritonéale (ip) 2 semaines après la première dose de MIT, puis administré toutes les deux semaines) a remarquablement amélioré la régression tumorale (55,2 % de réduction de la taille de la tumeur par rapport au MIT seul ; 74,9 % de réduction du volume de la tumeur par rapport au traitement placebo) (Fig. 5b). une, Schéma illustratif d'un schéma préclinique. Deux semaines après l'implantation sous-cutanée et l'absorption in vivo de recombinants tissulaires, les souris mâles NOD-SCID ont reçu des agents simples (mono) ou combinés (double) selon un calendrier métronomique composé de plusieurs cycles. BLI, imagerie par bioluminescence. b, Profilage statistique des volumes terminaux tumoraux. Des cellules PC3 ont été xénogreffées seules ou avec des cellules PSC27 dans le flanc arrière des animaux. c, Évaluation comparative de la sénescence in vivo par coloration SA-β-Gal. Les tumeurs ont été fraîchement disséquées après avoir tué les animaux et traitées sous forme de coupes congelées pour une coloration histologique. Barres d'échelle, 200 um. ré, Graphiques de violon illustrant les statistiques comparatives de la coloration SA-β-Gal dans les tissus tumoraux. Et, Test de transcription pour l'expression in vivo de plusieurs facteurs SASP canoniques dans des cellules stromales isolées de tumeurs. Les tissus d'animaux xénogreffés avec des cellules stromales et cancéreuses ont été soumis à un isolement par microdissection par capture laser et à des processus ultérieurs. Les données sont représentatives de trois réplicats biologiques (m = 10 animaux par groupe). Les ensembles de données sont affichés sous forme de tracés en boîte et en moustaches, dans lesquels une boîte s'étend du 25e au 75e centile avec la médiane indiquée par une ligne au milieu et des moustaches indiquant les valeurs les plus petites et les plus grandes. F, Profilage des transcrits SASP dans les cellules stromales. Les signaux correspondant à chaque facteur ont été normalisés par rapport à ceux du groupe traité avec le véhicule. Noter p16INK4a est également connu sous le nom CDKN2A et p21CIP1 est également connu sous le nom CDKN1A. g, Mesure statistique des cellules présentant des dommages à l'ADN et des cellules apoptotiques dans des échantillons biologiques collectés comme décrit dans une,b. Les valeurs sont présentées comme le pourcentage de cellules colorées positivement par immunohistochimie (IHC) avec des anticorps spécifiques à l'histone γH2AX ou à la caspase 3 (clivée). Pour b,ré-g, P les valeurs ont été calculées par bilatéral t-tests. h, Images IHC représentatives de la caspase 3 (clivée, CC3) à la fin des régimes thérapeutiques. Barres d'échelle, 100 m. je, Survie comparative de souris tuées après le développement de maladies volumineuses avancées. La durée de survie a été calculée à partir du moment de l'injection de tissu recombinant jusqu'à la mort de l'animal. SEP, survie médiane. P les valeurs ont été calculées par des tests de log-rank bilatéraux (Mantel-Cox). Données dans c,h sont représentatifs de trois expériences indépendantes. Les données dans tous les graphiques à barres sont présentées sous forme de moyenne ± écart-type et sont représentatives de trois répétitions biologiques. Nous avons ensuite testé si la sénescence cellulaire se produisait dans les foyers tumoraux de ces animaux. Sans surprise, l'administration de MIT a induit l'apparition d'un grand nombre de cellules sénescentes dans le tissu tumoral. Cependant, l'administration de PCC1 à ces animaux traités par chimiothérapie a épuisé la majorité des cellules sénescentes (Fig. 5c,d). La microdissection par capture laser suivie de tests de transcription a indiqué une expression significativement accrue des facteurs SASP, notamment IL6, CXCL8, SPINK1, WNT16B (aussi connu sous le nom WNT16), GM-CSF (aussi connu sous le nom CSF2), MMP3 et IL1A, une tendance accompagnée d'une régulation positive du gène codant pour le marqueur de sénescence p16INK4a chez les animaux traités par chimiothérapie (Fig. 5e et données étendues Fig. 6c). Ces changements ont été principalement observés dans les cellules stromales, plutôt que dans les cellules cancéreuses voisines, ce qui implique la possibilité d'un repeuplement des cellules cancéreuses résiduelles, qui développent fréquemment une résistance acquise dans le TME endommagé par le traitement. Cependant, lors de l'administration de PCC1, les changements associés à la SASP ont été largement inversés, comme le suggèrent les tests de transcription et l'ARN-seq (Fig. 5f et données étendues Fig. 6d). Pour étudier les mécanismes sous-jacents à l'expression de SASP chez les souris traitées au MIT, nous avons disséqué des tumeurs d'animaux traités avec ces deux agents 7 jours après la première dose d'administration de GSE, un moment avant le développement de colonies résistantes. Contrairement au traitement par placebo, l'administration de MIT a augmenté les dommages à l'ADN et l'apoptose, alors que le traitement avec PCC1 seul ne l'a pas fait (Fig. 5g). Cependant, lorsque les animaux traités au MIT ont été co-administrés PCC1, les dommages à l'ADN et l'apoptose ont été significativement augmentés, ce qui implique une cytotoxicité accrue chez les animaux recevant à la fois une chimiothérapie et des sénolytiques. Comme preuve à l'appui, nous avons observé un clivage élevé de la caspase 3, une caractéristique typique de l'apoptose cellulaire, lorsque PCC1 a été administré en même temps que le MIT (Fig. 5h). Nous avons ensuite évalué les conséquences de la progression tumorale en comparant la survie de différents groupes d'animaux au fil du temps. Dans cette cohorte préclinique, les animaux ont été surveillés pour la croissance tumorale, avec une maladie volumineuse considérée comme étant apparue une fois que la charge tumorale était importante (taille ≥ 2 000 mm3), une approche employée dans des études antérieures14,49. Les souris recevant le traitement combinatoire MIT-PCC1 ont montré la survie médiane la plus prolongée, survivant au moins 48,1 % plus longtemps que le groupe traité avec le MIT seul (Fig. 5i, vert contre bleu). Cependant, le traitement par PCC1 seul n'a prolongé que marginalement la survie. Nos données suggèrent que l'administration de PCC1 seule ne modifie pas la croissance tumorale ni ne favorise la survie des animaux, alors que la co-administration de PCC1 avec le MIT a des effets synergiques significatifs. Il convient de noter que les traitements effectués dans ces études semblaient être bien tolérés par les animaux, car aucune perturbation significative des taux d'urée, de créatinine ou d'enzymes hépatiques ou du poids corporel n'a été observée (données étendues Fig. 6e,f). Plus important encore, les agents chimiothérapeutiques et géroprotecteurs administrés à des doses optimisées dans cette étude n'ont pas interféré de manière significative avec l'intégrité du système immunitaire ou l'homéostasie tissulaire des organes critiques, même chez les souris immunocompétentes (Fig. 6a–c). Ces résultats soutiennent le raisonnement selon lequel les agents anti-vieillissement combinés à une chimiothérapie conventionnelle ont le potentiel d'améliorer la réponse tumorale sans provoquer de toxicité systémique sévère. Même un petit nombre de cellules sénescentes peut induire un dysfonctionnement physique chez les jeunes animaux50. Nous avons demandé si PCC1 tue sélectivement les cellules sénescentes in vivo et peut ainsi prévenir un dysfonctionnement physique. Pour répondre à cette question, nous avons réalisé une implantation parallèle de fibroblastes embryonnaires de souris témoins et sénescents (MEF, 0,5 × 106 cellules par côté) exprimant constitutivement la luciférase (LUC+) par voie sous-cutanée chez des souris syngéniques de type sauvage (WT). Immédiatement après l'implantation, les animaux ont été traités avec du PCC1 (à 20 mg par kg par injection ip) ou un véhicule (éthanol-polyéthylène glycol 400 - Phosal 50 propylène glycol (PG) à 10:30:60) pendant 7 jours (Fig. 6a). Nous avons constaté que les intensités du signal de luminescence étaient significativement plus faibles chez les souris implantées avec des cellules sénescentes et traitées avec PCC1 que celles des portées traitées avec le véhicule, bien qu'aucune différence n'ait été observée après le traitement des souris transplantées avec LUC+ cellules témoins (fig. 6b,c), démontrant l'efficacité sénolytique de PCC1 in vivo. une, Schéma des procédures expérimentales pour la transplantation cellulaire et les tests de fonction physique chez des souris mâles C57BL/6J âgées de 5 mois. b, Images représentatives montrant l'activité de la luciférase in vivo 2 jours après le dernier traitement des souris. Barres d'échelle, 20 mm. c, Luminescence des cellules transplantées en pourcentage par rapport aux signaux moyens chez les animaux traités avec le véhicule. ré-F, Mesure de la vitesse de marche maximale (par rapport à la ligne de base) (ré), endurance suspendue (Et) et la force de préhension (F) chez des souris mâles C57BL/6J âgées de 5 mois, avec des tests effectués 1 mois après le dernier traitement. g, Schéma de la conception expérimentale pour la transplantation et les mesures de la fonction physique. h-j, Mesure de la vitesse de marche maximale (par rapport à la ligne de base) (h), endurance suspendue (je) et la force de préhension (j) chez des souris mâles C57BL/6J de 28 semaines (2 semaines après le dernier traitement). à, Courbes de survie à un an d'animaux de 17 mois implantés avec 0,5 × 106 cellules MEF témoins et traitées avec véhicule (CTRL-véhicule) et souris implantées avec 0,5 × 106 cellules MEF sénescentes traitées soit avec un véhicule (SEN-véhicule) soit avec PCC1 (SEN-PCC1). Pointes de flèches rouges, implantation cellulaire (au 528e jour d'âge) ou à la fin de la mesure de survie (890e jour d'âge). P les valeurs ont été calculées par des tests de log-rank bilatéraux (Mantel-Cox). l, Quantification comparative de la charge de morbidité (à gauche) et de la charge tumorale (à droite) (indiquée par la médiane avec l'intervalle interquartile) après implantation de cellules sénescentes et traitement avec véhicule ou PCC1. m, Cause de décès chez les animaux qui ont reçu des cellules implantées et ont été traités avec le véhicule ou le PCC1. Pour ré-F,h-j, les données sont présentées sous forme de diagrammes en boîtes et en moustaches, dans lesquels les boîtes s'étendent du 25e au 75e centile avec la médiane représentée par une ligne au milieu, et les moustaches indiquent les valeurs les plus petites et les plus grandes. Pour c-F,h-j, P les valeurs ont été calculées par bilatéral t-tests. Nombre d'animaux, m = 5 par groupe pour c, m = 10 par groupe pour ré-j, m = 27 pour à et m = 13 pour l,m. NS, P > 0,05 ; *P <0,05 ; **P <0,01 ; ***P <0,001 ; ****P <0,0001. Nous avons ensuite étudié si le fait de tuer des cellules sénescentes implantées à l'aide de PCC1 pouvait atténuer les événements pathologiques, en particulier le dysfonctionnement physique. Le traitement de jeunes animaux avec PCC1 après implantation de cellules sénescentes pendant 1 semaine a permis d'éviter les baisses de la vitesse de marche maximale (RotaRod), de l'endurance de suspension (test de suspension) et de la force de préhension (mètre de préhension), changements observés dans un délai d'un mois après le traitement au véhicule d'un autre groupe de souris portant cellules sénescentes, cohérent avec le potentiel de PCC1 pour réduire le dysfonctionnement physique (Fig. 6d–f). L'administration de PCC1 a également empêché le dysfonctionnement physique qui s'est produit chez les animaux 5 semaines après l'implantation de cellules sénescentes (Fig. 6g). Chez les souris hébergeant des cellules sénescentes, une seule cure de 5 jours de traitement PCC1 a amélioré la fonction physique par rapport au traitement par véhicule (Fig. 6h–j). Il est à noter que l'amélioration était détectable 2 semaines après le traitement par PCC1 et a même duré plusieurs mois (Extended Data Fig. 7a,b). À ces deux moments d'administration de PCC1 (immédiatement contre 5 semaines après l'implantation de cellules sénescentes), les effets bénéfiques de PCC1 semblaient être comparables. Les données suggèrent que le calendrier d'administration du PCC1 peut être flexible, indiquant sa faisabilité clinique potentielle. Comme les procyanidines dérivées de graines végétales ont généralement des demi-vies d'élimination de <12 h51,52, une telle amélioration soutenue de la fonction physique après une seule cure de PCC1 évite la nécessité d'un traitement continu avec l'agent sénolytique, ce qui implique en outre que l'activité de PCC1 est suffisante pour éviter un dysfonctionnement physique induit par les cellules sénescentes. Nous avons ensuite cherché à évaluer l'impact des cellules sénescentes ou le bénéfice de leur élimination chez des animaux d'âge moyen. À cette fin, nous avons utilisé des souris C57BL/6J âgées de 17 mois, qui ont été implantées avec des MEF témoins ou sénescents. Notamment, la survie des animaux porteurs de cellules sénescentes et recevant un traitement par véhicule l'année suivante était significativement inférieure à celle des animaux recevant un traitement PCC1, avec un risque de décès 2,4 fois plus élevé (hazard ratio, P = 0,0172) (Fig. 6k). Cependant, la charge de morbidité, la charge tumorale au décès et les causes de décès n'étaient pas significativement différentes entre les souris traitées avec le véhicule et celles traitées avec PCC1 (Fig. 6l,m). Ces données suggèrent qu'un petit nombre de cellules sénescentes pourrait affecter la survie par un processus général, tel que l'accélération de la progression du vieillissement, plutôt qu'en provoquant une pathologie spécifique ou quelques conditions individuelles. L'augmentation de la charge de cellules sénescentes entraîne un dysfonctionnement physique, une tendance associée à la mortalité d'âge moyen mais pouvant être retardée par l'administration de sénolytiques tels que le PCC1. Les sénolytiques épuisent les cellules sénescentes dans divers tissus et organes dans diverses situations physiopathologiques, dont la plupart sont corrélées avec le vieillissement53. Pour examiner plus avant l'effet de PCC1 sur les cellules sénescentes dans les organismes et le vieillissement de l'organisme, nous avons sélectionné deux modèles animaux indépendants de sénescence in vivo, y compris des souris soumises à un traitement et des souris vieillissantes naturellement. Tout d'abord, nous avons induit la sénescence cellulaire en exposant des souris WT à une irradiation du corps entier (WBI) à une dose sublétale (5 Gy), une étape suivie d'un traitement géroprotecteur avec PCC1 (20 mg par kg par injection ip) ou un véhicule (éthanol-polyéthylène glycol 400–Phosal 50 PG à 10:30:60) (une fois par semaine) (Fig. 7a). Il est à noter que les animaux qui avaient subi une WBI présentaient une apparence corporelle anormale, y compris des cheveux nettement gris, qui, cependant, ont été largement inversés par l'administration de PCC1 (Fig. 7b,c). Des cellules sénescentes SA-β-Gal-positives ont été induites in vivo chez ces animaux, comme en témoigne l'augmentation de la positivité de la coloration dans les tissus cardiaques et pulmonaires (Fig. 7d,e). Cependant, lorsque nous avons traité avec PCC1 par injection ip, le pourcentage de cellules SA-β-Gal-positives dans les tissus disséqués était significativement réduit, contrairement à celui des souris traitées avec le véhicule au stade post-WBI (Fig. 7f,g). Le traitement PCC1 a également diminué l'expression des marqueurs de sénescence et d'un sous-ensemble de facteurs SASP clés par rapport au traitement par véhicule (Fig. 7h). En résumé, les données suggèrent que PCC1 peut épuiser efficacement les cellules SA-β-Gal-positives, contrôler l'expression de SASP et minimiser la charge de cellules sénescentes dans des conditions in vivo chez la souris. une, Schéma de la procédure expérimentale pour les souris subissant des tests WBI et de la fonction physique. b, Comparaison instantanée du corps entier de souris mâles C57BL/6J naïves, exposées au WBI suivi d'un traitement par véhicule ou exposées au WBI et traitées au PCC1, respectivement. c, Une photo en cage d'animaux décrits dans une dans des conditions précliniques. ré, Images représentatives de la coloration SA-β-Gal du tissu cardiaque de souris non traitées (naïves) et traitées au WBI soumises à un véhicule ou à un traitement PCC1. Barre d'échelle, 200 m. Et, Images représentatives de la coloration SA-β-Gal du tissu pulmonaire de souris comme décrit dans ré. Barre d'échelle, 200 m. F, Statistiques comparatives de la coloration SA-β-Gal du tissu cardiaque des animaux examinés dans ré. g, Statistiques comparatives de la coloration SA-β-Gal du tissu pulmonaire des animaux examinés dans Et. h, Mesure quantitative de l'expression de la SASP au niveau de la transcription dans des tissus prélevés sur des animaux traités dans les conditions décrites dans une. je,j, Mesure de la distance parcourue sur le tapis roulant (je) et la force de préhension (j) de souris expérimentales. Pour F-j, P les valeurs ont été calculées par bilatéral t-tests. à, Analyse de survie Kaplan-Meier de souris C57BL/6J exposées au WBI et traitées chaque semaine avec le véhicule ou le PCC1, avec des souris naïves comme contrôle non traité. IC, intervalle de confiance ; HR, rapport de risque ; DFI, intervalle sans maladie. P les valeurs ont été calculées par des tests de log-rank bilatéraux (Mantel-Cox). Les données dans les graphiques à barres sont présentées sous forme de moyenne ± écart-type et sont représentatives de trois expériences indépendantes. NS, P > 0,05 ; *P <0,05 ; **P <0,01 ; ***P <0,001 ; ****P <0,0001. Nous avons ensuite évalué l'impact des traitements précliniques sur les paramètres physiques des souris. Comme prévu, le WBI a considérablement compromis la capacité d'exercice et la force musculaire mesurées par des tests sur tapis roulant et force de préhension dans le groupe véhicule (Fig. 7i,j). En revanche, l'administration du PCC1 a apporté un bénéfice substantiel en restaurant ces capacités. Plus important encore, le traitement PCC1 a augmenté le taux de survie (Fig. 7k). Nos résultats indiquent que l'élimination induite par PCC1 des cellules sénescentes SA-β-Gal-positives pourrait être une stratégie efficace pour atténuer la régression physique liée à la sénescence et réduire la mortalité dans les contextes de vieillissement prématuré déclenché par des facteurs de stress environnementaux tels que la thérapie cytotoxique. Nous avons ensuite cherché à définir l'impact des cellules sénescentes sur la fonction physique chez les animaux vieillissant naturellement. À cette fin, nous avons traité des souris WT normales de 20 mois avec un véhicule (éthanol-polyéthylène glycol 400-Phosal 50 PG à 10:30:60) ou PCC1 (20 mg par kg par injection ip) (une fois toutes les 2 semaines) pendant 4 mois (fig. 8a). L'évaluation histologique a révélé un pourcentage significativement élevé de cellules sénescentes SA-β-Gal-positives dans les reins, le foie, les poumons et la prostate des animaux âgés, qui a été inversé par le traitement PCC1 (Fig. 8b, c et données étendues Fig. 8a–f). Les résultats des tests physiques ont montré que le PCC1 soulageait le dysfonctionnement physique en améliorant la vitesse de marche maximale, l'endurance à la suspension, la force de préhension, l'endurance sur tapis roulant, l'activité quotidienne et les performances d'équilibre du faisceau des animaux ayant reçu du PCC1 par rapport à ceux traités avec un véhicule (Fig. 8d–i), le poids corporel et l'apport alimentaire sont restés en grande partie inchangés chez les souris traitées au PCC1 (Extended Data Fig. 8g,h). Notamment, l'expression de la SASP était significativement réduite dans des tissus tels que les poumons de souris âgées traitées avec PCC1 par rapport à celle du groupe traité avec le véhicule (Fig. 8j), un schéma cohérent avec une moindre sécrétion de facteurs SASP par les tissus stromales humains traités avec PCC1 (Fig. 5f). une, Conception schématique pour l'examen physique de souris mâles C57BL/6J âgées de 20 mois traitées avec PCC1 une fois toutes les 2 semaines (toutes les deux semaines) pendant 4 mois. b, Images représentatives de la coloration SA-β-Gal des reins de souris jeunes et âgées traitées avec le véhicule ou le PCC1. Barre d'échelle, 200 m. c, Quantification de la coloration SA-β-Gal comme décrit dans b. Les données représentent la moyenne ± écart-type ré-h, Quantification de la vitesse de marche maximale (par rapport à la ligne de base) (ré), endurance suspendue (Et), force de préhension (F), endurance sur tapis roulant (g) et l'activité quotidienne (h) de souris mâles C57BL/6J âgées de 20 mois après le traitement de 4 mois. je, Quantification du temps nécessaire pour franchir le fléau. Les points de données avant et après le traitement de chaque animal sont connectés pour permettre une comparaison directe des effets du traitement. j, Profilage quantitatif du transcrit de l'expression de la SASP dans les tissus pulmonaires prélevés sur des souris non traitées de 6 mois (6M), traitées avec un véhicule de 24 mois (véhicule de 24M) et traitées par PCC1 de 24 mois (24M-PCC1) . Les données sont présentées sous forme de moyenne ± écart-type et ont été dérivées de trois réplicats biologiques (m = 3 tests indépendants). à, Conception schématique pour les analyses de la durée de vie de souris (des deux sexes) âgées de 24 à 27 mois. l,m, Survie après traitement (l) et la survie tout au long de la vie (m) courbes des animaux C57BL/6J traités toutes les deux semaines avec PCC1 (m = 91 ; 48 hommes, 43 femmes) ou véhicule (m = 80 ; 42 hommes, 38 femmes) à partir de 24 à 27 mois. m, Vitesse de marche maximale et endurance à la suspension en moyenne au cours des 2 derniers mois de vie (m = 10 souris par groupe) et la durée de vie des souris les plus anciennes (top 20) dans les deux groupes. le, Charge de morbidité et charge tumorale au décès. Pour les deux sexes, m = 60 souris par bras. Pour les hommes, m = 31 pour PCC1 et m = 33 pour le véhicule. Pour les femelles, m = 29 pour PCC1 et m = 27 pour le véhicule. Pour c-h,j, m = 3 tests biologiquement indépendants. Les données sont affichées sous forme de diagrammes en boîtes et en moustaches, dans lesquels une boîte s'étend du 25e au 75e centile avec la médiane représentée par une ligne au milieu, et les moustaches indiquent les valeurs les plus petites et les plus grandes (ré-h,m) ou en moyenne ± écart-type (le). Bilatéral non apparié t-tests (c-j,m,le) et les modèles de régression à risque proportionnel de Cox (l,m) ont été utilisés pour déterminer la signification statistique. Pour établir le potentiel de l'élimination des cellules sénescentes pour prolonger la durée de vie restante des souris WT, nous avons effectué un traitement PCC1 en commençant à un âge très avancé (Fig. 8k). Les souris recevant l'administration de PCC1 (une fois toutes les 2 semaines ou toutes les deux semaines) à partir de l'âge de 24 à 27 mois (environ l'équivalent d'un âge de 75 à 90 ans chez l'homme) ont eu une durée de vie médiane après traitement 64,2 % plus longue (ou 9,4 % plus longue dans l'ensemble). durée de vie) et un risque de mortalité plus faible (65,0 %, P < 0,0001) que le groupe traité par véhicule (Fig. 8l,m). Ces données indiquent que PCC1 peut réduire considérablement le risque de mortalité associée à l'âge chez les souris âgées. Nous nous sommes ensuite demandé si la réduction du taux de mortalité chez les animaux âgés s'accompagnait d'une augmentation de la morbidité en fin de vie. Nous avons mesuré la fonction physique chez des souris expérimentales traitées avec PCC1 ou un véhicule tous les mois jusqu'à la mort. Malgré la durée de vie restante plus longue chez les souris traitées au PCC1, la fonction physique au cours des 2 derniers mois de la vie n'était pas significativement inférieure à celle des souris traitées avec le véhicule (Fig. 8n). À l'autopsie, l'incidence de plusieurs pathologies liées à l'âge, la charge tumorale et la cause de décès n'étaient pas significativement différentes entre les souris traitées par PCC1 et celles traitées par le véhicule (Fig. 8o et données étendues Fig. 9a,b). Cependant, l'expression de la SASP était réduite dans les organes solides, ce qui était largement compatible avec la baisse des taux circulants d'interleukine (IL)-6, de facteur de stimulation des colonies (CSF)2 et de protéine chimiotactique des monocytes (MCP)1, des marqueurs SASP représentatifs dans le sang périphérique (Extended Data Fig. 9c - f). Nous avons également observé une diminution de l'expression de la SASP dans CD3+ Cellules T dans le sang périphérique (Extended Data Fig. 9g), une lignée cellulaire qui présente une forte augmentation de p16INK4a expression au cours du vieillissement humain54. De plus, le traitement par PCC1 a réduit le stress oxydatif dans les tissus hépatiques, comme en témoigne une diminution des adduits du produit de peroxydation lipidique 4-hydroxynonénal (HNE) et une augmentation du rapport entre glutathion réduit et oxydé (données étendues Fig. 9h, je), en accord avec les propriétés générales des flavonoïdes, qui exercent une activité antioxydante en luttant contre les radicaux libres et en engageant le système de défense antioxydant55,56. En somme, l'agent sénolytique PCC1, un composant phytochimique dérivé du GSE (ou alternativement, en moindre abondance, de produits naturels tels que les extraits de cannelle, de cacao, d'écorces de pomme et d'écorce de pin), peut réduire le fardeau des cellules sénescentes et éventuellement d'autres cellules. développer un phénotype pro-inflammatoire et intrinsèquement dépendant des voies anti-apoptotiques associées à la sénescence pro-survie et augmenter la durée de vie post-traitement sans provoquer une morbidité élevée chez la souris. Nous présentons ici la preuve de principe que, même lorsqu'elle est administrée en fin de vie, une telle modalité thérapeutique a un potentiel important pour retarder remarquablement le dysfonctionnement lié à l'âge, réduire les maladies liées à l'âge et améliorer les conditions de santé, offrant ainsi une nouvelle voie pour améliorer l'espérance de vie et la durée de vie dans la future médecine gériatrique. Le vieillissement est un processus essentiellement inévitable qui provoque progressivement un déclin fonctionnel dans presque tous les organismes. La sénescence cellulaire, un état d'arrêt permanent de la croissance, est récemment apparue à la fois comme une caractéristique et un moteur du vieillissement3,57. Les cellules sénescentes s'accumulent dans les tissus âgés au fil du temps et contribuent à une liste croissante de pathologies58. L'élimination des cellules sénescentes des souris progéroïdes ou naturellement âgées prolonge la durée de vie, augmente la durée de vie et limite les troubles liés à l'âge, y compris, mais sans s'y limiter, l'athérosclérose, l'arthrose et les maladies neurodégénératives59,60,61,62. Les progrès récents des études liées à l'âge ont incité à rechercher des médicaments pouvant cibler sélectivement les cellules sénescentes, en particulier une nouvelle classe d'agents géroprotecteurs appelés sénolytiques ou, de manière moins agressive, sénomorphes. À ce jour, une poignée de sénolytiques ont été signalés, notamment le dasatinib et la quercétine, la fisétine, la piperlongumine, les inhibiteurs de la protéine de choc thermique (HSP)90 et les inhibiteurs de la famille BCL-2 tels que l'ABT-263 (navitoclax) et l'ABT-737 (réf. 11,12,13,18,19,21,22). Parmi eux, les inhibiteurs de BCL-2 sont les sénolytiques les plus largement utilisés, bien qu'à l'origine développés comme thérapies pour le lymphome. ABT-737 cible BCL-2, BCL-xL et BCL-w mais avec une faible solubilité et biodisponibilité orale. Plus efficace pour une utilisation in vivo, l'ABT-263 inhibe principalement BCL-2 et BCL-xL, alors qu'il provoque fréquemment une thrombocytopénie. Compte tenu des effets secondaires marqués de certains composés sénolytiques, il existe un besoin d'identifier de nouveaux composés ayant une activité sénolytique mais une cytotoxicité réduite. Dans cette étude, nous avons passé au crible une bibliothèque de médicaments à base de PDMA composée principalement de produits naturels dans le but d'identifier de nouveaux agents pouvant cibler largement les cellules sénescentes avec une efficacité et une sécurité optimales in vivo. En conséquence, nous avons identifié le PCC1, un agent phytochimique dérivé de sources naturelles, en tant que composé sénolytique à large spectre. Comme avantage particulier, PCC1 peut également agir comme un agent sénomorphe pour minimiser l'expression de SASP lorsqu'il est utilisé à de faibles concentrations. Une caractéristique aussi avantageuse de PCC1 ressemble en effet largement à celle de GSE, qui peut générer à la fois des effets sénomorphes et sénolytiques. Les stratégies génétiques et pharmacologiques ont démontré un éventail d'avantages de l'élimination des cellules sénescentes pour retarder le vieillissement et contrôler les maladies. La sénescence cellulaire peut être déclenchée par une variété de stimuli allant de l'activation oncogène, au stress génotoxique, à la réponse inflammatoire et à l'épuisement réplicatif. Plusieurs composés sont identifiés comme sénolytiques à large spectre, tandis que d'autres ne sont sélectifs que contre un certain type de cellules sénescentes. Les différences de spécificité impliquent des choix individuels de sénolytiques, qui dépendent principalement de leur utilisation clinique prévue. Une étude récente a révélé l'ouabaïne, un composé naturel appartenant à la famille des glycosides cardiaques, en tant qu'agent sénolytique pouvant être utilisé à la fois pour l'élimination des cellules sénescentes et le traitement du cancer, ce dernier mis en œuvre par un double mécanisme d'action63. Dans ce travail, nous avons découvert PCC1 comme un autre nouveau sénolytique naturel et puissant, qui induit sélectivement et spécifiquement l'apoptose des cellules sénescentes mais avec une cytotoxicité limitée pour les cellules en prolifération.64. Il est à noter qu'à des concentrations plus faibles, le PCC1 inhibe l'expression de la SASP, une propriété partagée par certains flavonoïdes dérivés de plantes tels que l'apigénine et le kaempférol, qui peuvent agir comme sénomorphes pour limiter l'impact des cellules sénescentes sur les conditions liées à l'âge.65,66. Bien que peu d'études aient révélé un tel mécanisme d'agents naturels dans le ciblage des cellules sénescentes, la surface de la quercétine récemment synthétisée a fonctionnalisé Fe.3LA4 les nanoparticules ont présenté un potentiel à la fois sénolytique et sénomorphique dans les fibroblastes humains en améliorant l'activité de la protéine kinase activée par l'AMP (AMPK)67. Le mécanisme par lequel PCC1 obtient des effets sénolytiques semble complexe et nécessite une étude plus approfondie. Nos données suggèrent que PCC1 altère l'intégrité fonctionnelle des mitochondries, compromettant m, entraînant une production accrue de radicaux libres tels que les ROS et provoquant la libération de cytochrome c dans les cellules sénescentes mais pas dans les cellules en prolifération. Une raison possible de cette spécificité est que les cellules sénescentes ont tendance à développer une membrane plasmique dépolarisée et ont des concentrations accrues de H+ (réf. 64), une caractéristique qui pourrait les rendre plus sensibles à l'action de PCC1. Il convient de noter que ces altérations s'accompagnent d'une expression régulée à la hausse de facteurs pro-apoptotiques, en particulier NOXA et PUMA, des événements qui favorisent également de manière critique l'apoptose des cellules sénescentes. Au sein de la famille des procyanidines, dont les membres sont connus pour dériver de la polymérisation de molécules de flavan-3-ol et existent sous forme d'oligomères ou de polymères28, PCC1 semble être fonctionnellement unique. Nos données expérimentales impliquent une différence notable entre le PCC1 (un trimère) et les autres procyanidines (dont la plupart sont en effet des monomères ou des dimères, comme le PCB2). Étant donné que nous n'avons pas testé de manière exhaustive les membres de la famille des procyanidines, le nombre de monomères dans la molécule détermine-t-il son potentiel anti-sénescence reste une question ouverte mais intrigante, et les mécanismes sous-jacents méritent des études continues à l'avenir. La sénescence cellulaire en soi est un processus très hétérogène qui dépend de différentes origines cellulaires et de stimuli environnementaux68. L'une des principales caractéristiques du PCC1 est sa capacité à éliminer efficacement les cellules sénescentes dans un large éventail de types cellulaires et de facteurs de stress, y compris la réplication, les oncogènes, l'irradiation et la chimiothérapie. Dans cette étude, nous avons comparé PCC1 avec d'autres sénolytiques signalés pour les effets sur les cellules stromales humaines, les fibroblastes, les HUVEC et les MSC, les principaux types de cellules dans le microenvironnement tissulaire. Comme indiqué, l'ABT-263 élimine les fibroblastes embryonnaires humains sénescents (FHE) et les HUVEC, mais a peu d'effet sur les pré-adipocytes humains12,18. L'utilisation combinée de dasatinib et de quercétine peut épuiser les trois types de cellules sénescentes de manière dose-dépendante, mais est toxique pour les cellules en prolifération11,69,70. La fisétine, un autre flavonoïde naturel signalé comme agent sénolytique, présente des effets modestes sur les HEF sénescents et les pré-adipocytes uniquement à des concentrations élevées20,21. En revanche, PCC1 a le potentiel de surmonter ces limitations, y compris la dépendance au type cellulaire, la toxicité élevée dans les cellules non sénescentes et la faible efficacité contre les cellules sénescentes. Bien que, lorsqu'elle est utilisée seule, la quercétine (un autre flavonoïde du GSE) en soi présente une cytotoxicité contre les cellules stromales sénescentes, son efficacité est généralement inférieure à celle du PCC1 (comparer Fig. 2a,c et Figs supplémentaires. 3n et 4n). Ensemble, PCC1 a une activité sénolytique supérieure avec une spécificité et une efficacité élevées pour un plus large éventail de types de cellules que de nombreux sénolytiques rapportés tels que l'ABT-263, le dasatinib, la quercétine et la fisétine et peut cibler les cellules sénescentes générées par plusieurs principaux types d'inducteurs de sénescence. Nous avons constaté que PCC1 exerce un effet inducteur d'apoptose sur les cellules sénescentes dans des conditions in vivo. PCC1 a éliminé efficacement les cellules sénescentes induites par la thérapie et réduit les marqueurs de sénescence dans les organes solides, mettant en évidence son efficacité in vivo. Dans cette étude, nous avons également traité des souris naturellement âgées avec PCC1 et testé ses effets sur les cellules sénescentes, l'inflammation chronique et la fonction physique. Tout d'abord, le traitement PCC1 a appauvri les cellules sénescentes dans plusieurs tissus et a diminué les signatures associées au SASP, comme le montre l'analyse GSEA. Deuxièmement, PCC1 pourrait supprimer l'expression des gènes associés à la SASP dans les foies et les reins âgés et réduire l'inflammation chronique de bas grade dans le sang. Troisièmement, PCC1 a atténué la fonction motrice, l'équilibre, l'exercice épuisé, la force musculaire et l'exploration spontanée chez les souris âgées. Plus important encore, les performances sur RotaRod et les tests d'équilibre du faisceau dans le groupe traité par PCC1 ont été améliorées par rapport à celles de la condition initiale de prétraitement. Collectivement, le composé phytochimique PCC1 cible sélectivement les cellules sénescentes dans le microenvironnement tissulaire et génère des effets biologiques remarquables chez des souris naturellement âgées. Semblables à leurs homologues synthétisés chimiquement, les procyanidines d'origine naturelle manifestent des activités anti-inflammatoires, anti-arthritiques, anti-allergiques et anticancéreuses, piègent les radicaux libres d'oxygène et suppriment l'activité de peroxydation induite par les rayonnements36,71. En tant que trimère d'épicatéchine isolé de la matière végétale, principalement des pépins de raisin, le PCC1 s'est avéré bénéfique pour la santé dans les conditions pathologiques chroniques72. Cependant, une évaluation approfondie des effets toxicologiques du PCC1 in vivo est cruciale pour une application clinique potentielle. Nos données ont montré qu'un traitement à haute concentration (20 mg par kg) et à haute fréquence de PCC1 (toutes les deux semaines) n'avait aucune toxicité systémique apparente. En résumé, notre étude démontre la supériorité et la sécurité relative d'une stratégie géroprotectrice qui cible sélectivement les cellules sénescentes dans les tissus âgés ou endommagés par le traitement dans un large éventail de types cellulaires. Cependant, il est possible que les concentrations de PCC1 in vivo varient entre les organes et dépendent de la dose administrée, de la pharmacodynamique et de la pharmacocinétique et que les concentrations locales ne soient pas suffisamment élevées pour obtenir un effet sénolytique dans certains types de tissus. Dans ce cas, Dans l'ensemble, notre étude ouvre une nouvelle voie pour allonger l'espérance de vie et prolonger la durée de vie et traiter les pathologies liées à l'âge avec un agent sénothérapeutique (avec un potentiel à la fois sénomorphe et sénolytique), qui est dérivé de sources naturelles et possède une efficacité prononcée. Les effets anti-âge potentiels de PCC1 démontrés dans nos tests précliniques fournissent un bon support pour le développement translationnel et clinique de PCC1, dans le but global d'atteindre une vie plus longue et plus saine.Principale
Résultats
De faibles concentrations de GSE restreignent l'expression de SASP
Le GSE a une activité sénolytique à des concentrations élevées
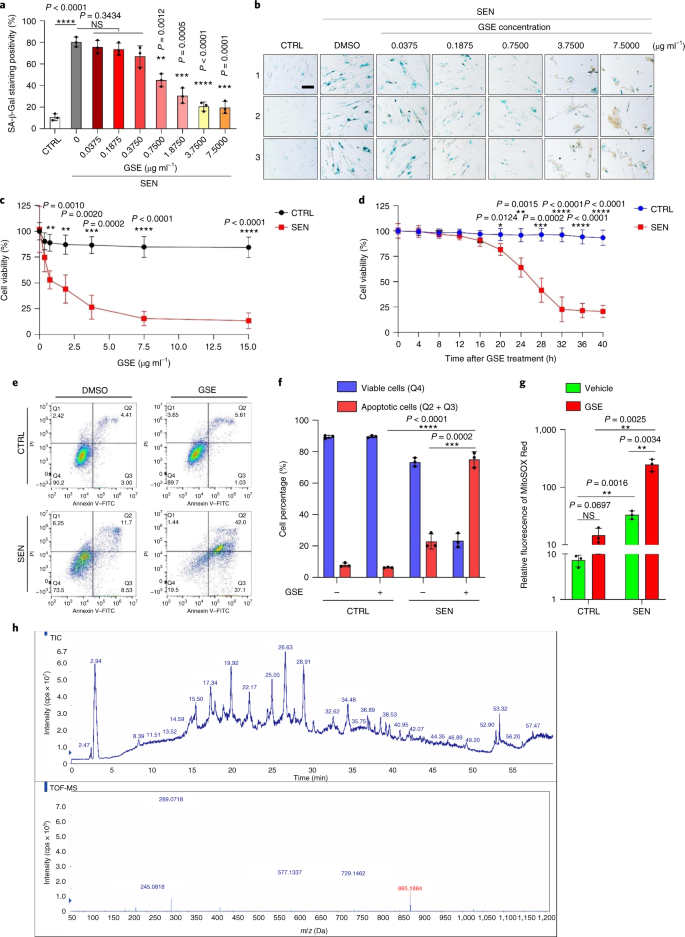
Le composant PCC1 du GSE a une activité sénolytique
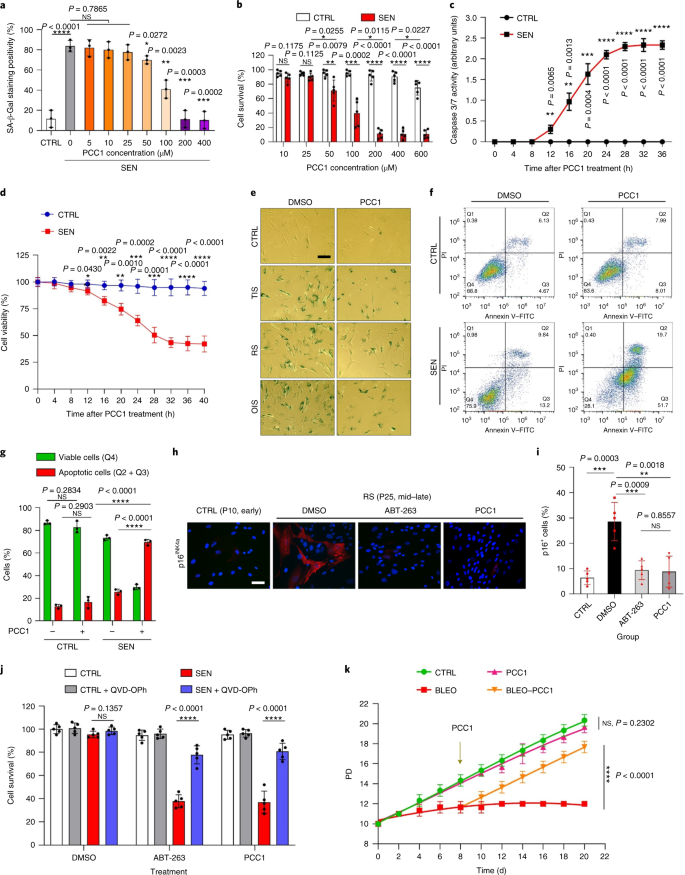
PCC1 induit un dysfonctionnement mitochondrial dans les cellules sénescentes
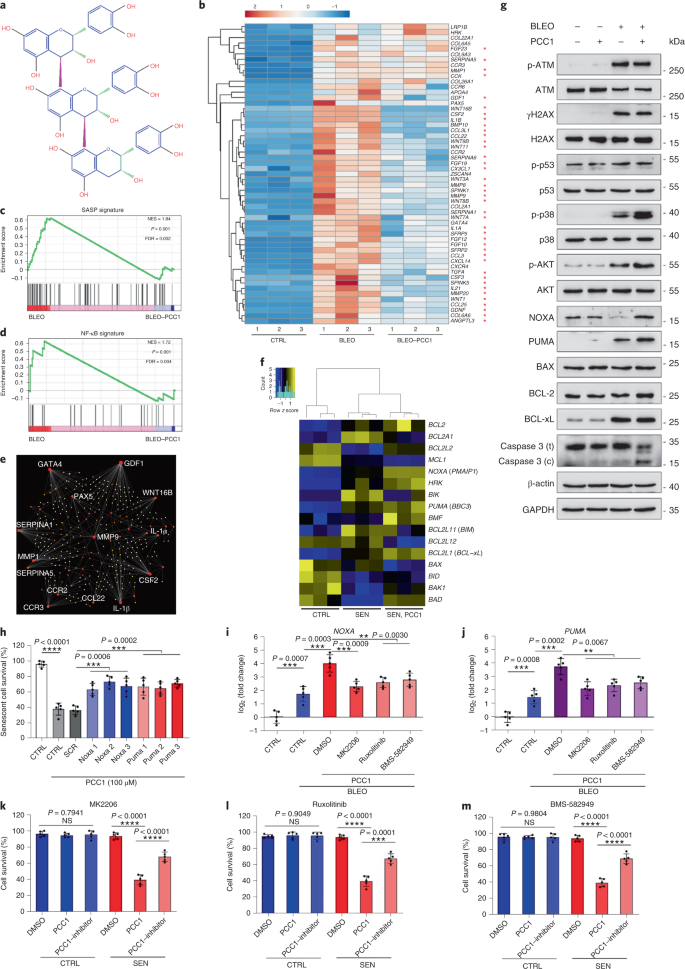
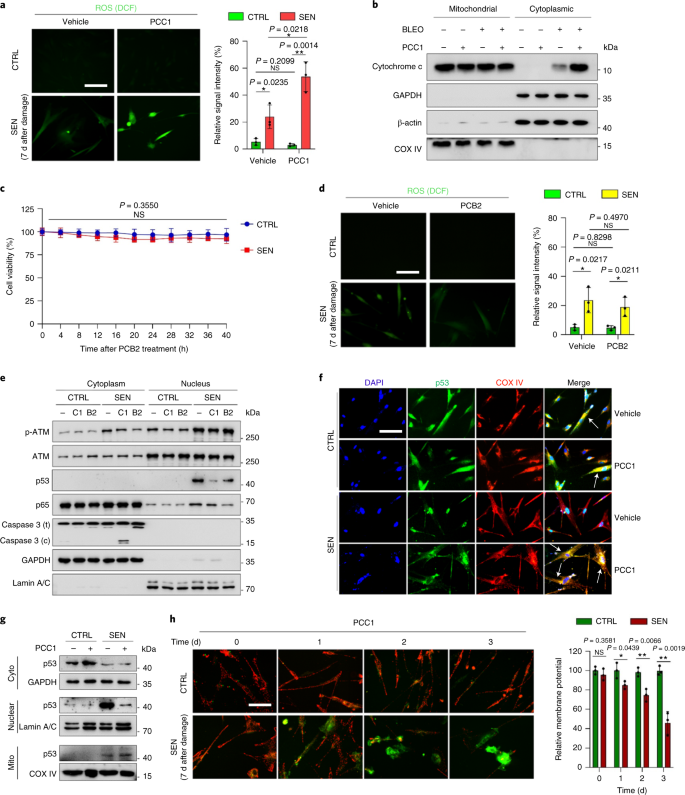
PCC1 favorise la régression tumorale et réduit la chimiorésistance

L'élimination des cellules sénescentes à la suite du traitement PCC1 atténue le dysfonctionnement physique
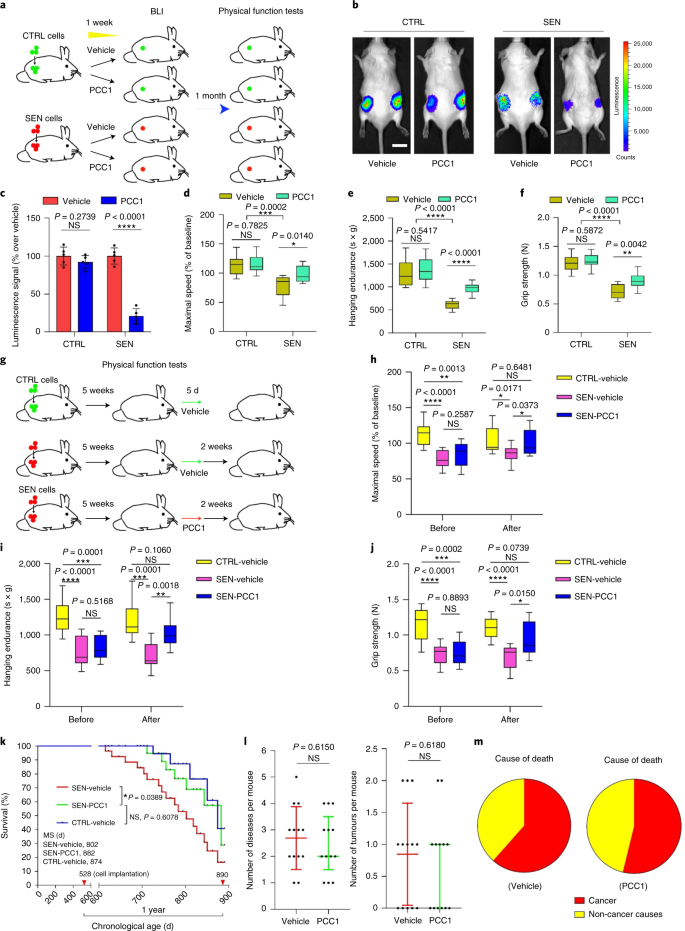
PCC1 soutient la fonction physique et prolonge la survie des souris âgées
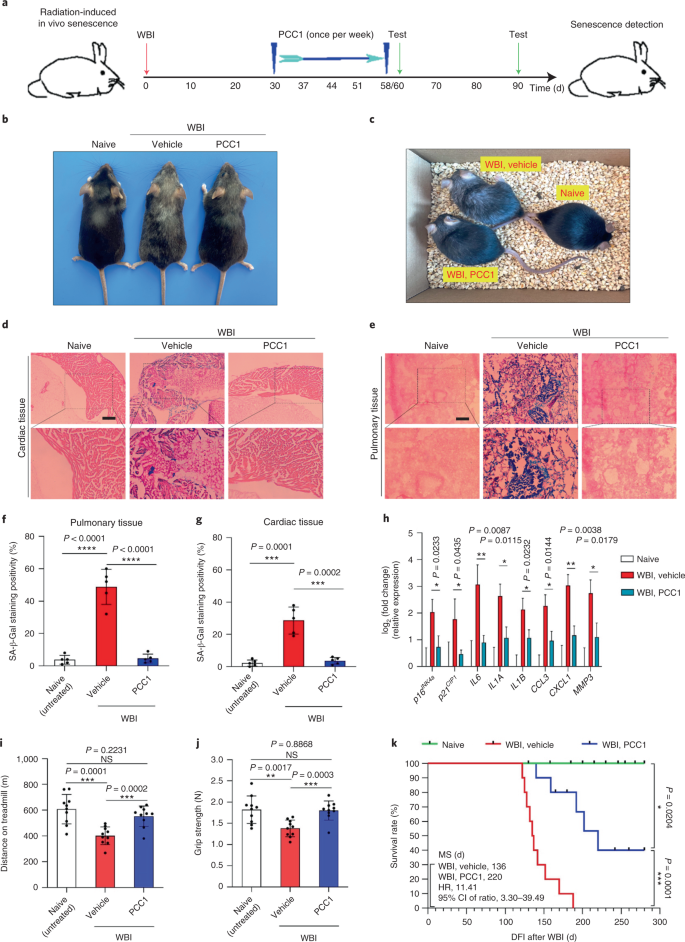
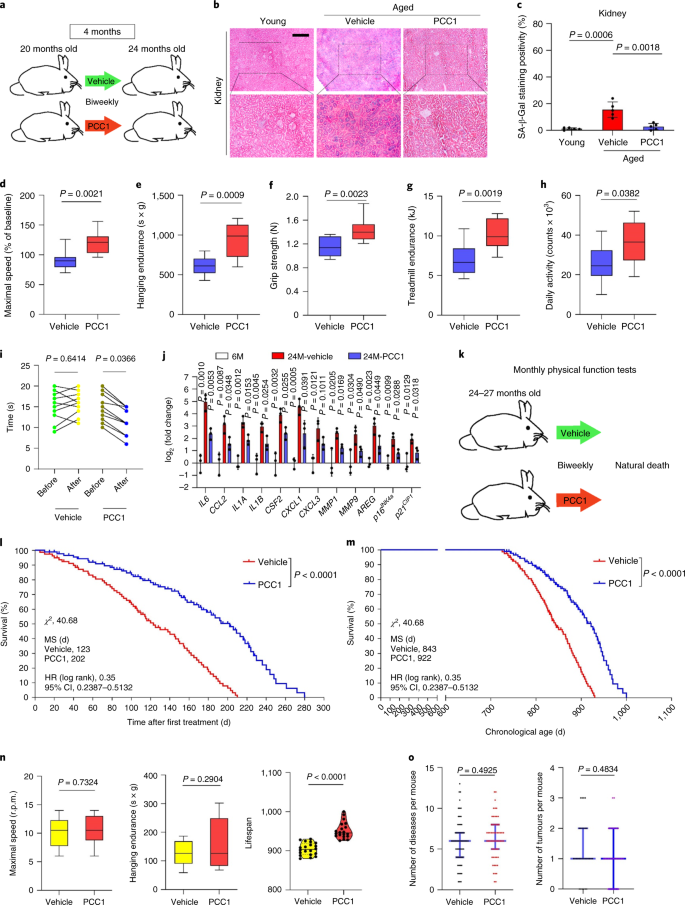
Discussion




